Partager la publication "Les processus cicatriciels excluent l’évolution"
Par Dr Jean-Maurice Clercq
Résumé: Dans Le Cep n° 75, la note n° 3, en page 18 d’un article d’Éric Brucker, attira l’attention de l’auteur du présent article. On y lisait : « Pensons à l’impact du microscope électronique, qui nous révèle une complexité et une miniaturisation insoupçonnées dans une “simple” cellule. Le concept même d’une évolution “progressive” (inspirée jadis par l’anatomie) s’en trouve presque dénué de sens. » Lorsque Johann Gregor Mendel (1822, Silésie – 1884, Moravie) découvrit les lois de l’hérédité biologique, les évolutionnistes cherchèrent d’abord à les étouffer ; en effet, ce moine autrichien montrait que les caractères qualifiés de « nouveaux » étaient seulement des caractères restés « récessifs » durant une ou plusieurs générations, mais dont une combinaison génétique différente avait finalement permis l’expression. Avec la théorie des mutations, en 1910, on crut la difficulté écartée (du « nouveau » pourrait donc apparaître et se transmettre héréditairement) et l’on sut alors « redécouvrir » les travaux de Mendel. Un siècle a passé et les évolutionnistes ont introduit les notions de « génétique » et d‘« ADN » dans leur argumentaire, notions destinées à impressionner le public, mais le plus souvent sans comprendre vraiment ce qui était en cause et en affirmant, toujours sans démonstration, qu’il y avait des « sauts évolutifs » dans la transmission héréditaire. Or les techniques se perfectionnent et font découvrir dans les processus cellulaires une telle complexité de structures et un tel ordre de coordination que l’idée d’un hasard organisateur devient insoutenable. Nous ne ferons ici qu‘entrevoir, avec la cicatrisation d’une banale blessure, ce monde infiniment petit, avec son autonomie et son extraordinaire organisation, ordonnée à ses fins bien ciblées grâce à des cascades d’informations circulant dans le sang, à faire pâlir d’envie un ingénieur informaticien ! Non, nul hasard n’a sa place ici, car la moindre erreur y serait fatale pour l’organisme entier. Ainsi le concept d’évolution se trouve-t-il, à ce niveau, entièrement dénué de sens, tant il se montre simpliste et décalé face à cette complexité et à cette finesse manifestée dans les processus du vivant.
Darwin, ses partisans, ses successeurs et compagnie, n’ont jamais su proposer d’argumentation scientifique crédible démontrant une évolution progressive. Aussi, à défaut de présenter des preuves, les partisans de la théorie évolutionniste se contentent d’affirmations péremptoires, souvent dans un langage destiné à donner l’idée d’un haut débat scientifique. Aussi de nos jours, l’introduction de mots et de concepts tirés de l’anatomo-pathologie et de la génétique enrichit-elle leur répertoire sans pour autant que soit produit un seul article établissant le bien-fondé de la thèse.
I. Le processus cicatriciel exclut l’évolution.
Selon la théorie (bien hypothétique), la vie sortit des océans. Nous n’allons cependant pas analyser la complexité génétique des algues unicellulaires, qui exclut déjà, dans cette forme de vie supposée « primitive » , tout hasard évolutif. En vue de tester l’hypothèse d‘une complexité croissante du vivant, nous allons nous pencher sur un mammifère terrestre, l’homme, parce qu’il est le plus étudié et le mieux connu (quoiqu‘encore inconnu à maints égards !). Chacun est confronté au cours de sa vie, à un moment où à un autre, à une blessure, peu importe son importance ou sa cause. La blessure (coupure, traumatisme ou piqûre, etc.) aura inévitablement provoqué la section de capillaires de plus ou moins grande taille. C’est-à-dire que le sang va s’écouler d’une manière plus ou moins discrète ou abondante. C’est un événement bien banal si le saignement s’arrête, ce à quoi nous sommes habitués car l’hémostase intervient rapidement. Si tel n’était pas le cas, le sang continuerait de s’écouler et le corps se viderait, entraînant la mort. Certains objecteront déjà que ce dernier cas est théorique, irréaliste. Cependant, des cas de décès suite à de petites coupures qui n’arrêtaient pas de saigner ont été notés en médecine légiste1.
D’autres argumenteront que les poils, et même la peau, des mammifères sauvages possèdent des propriétés protectrices telles que ces animaux s’en trouvent protégés, et donc que le faible nombre des décès par hémorragie n’empêcherait pas la survie de l’espèce. Mais, sous l’angle évolutionniste, on peut estimer que l’homme se situe en régression par rapport aux animaux, puisqu’il aurait manqué ce saut évolutif positif.
Fig. 1 : La trame de vaisseaux sanguins
Il fut donc nécessaire pour notre survie que, d’emblée, notre système circulatoire sanguin possédât un système efficace d’arrêt des saignements et de réparation des tissus lésés.
Ceci ne peut pas se faire progressivement, par étapes incomplètes, car il s’agit d’un processus indispensable à la vie.
Chez tous les mammifères, la coagulation du sang s’écoulant de l’organisme repose sur la formation d’un clou plaquettaire ainsi que sur des composantes protéiques de coagulation (ou facteurs de coagulation). Sans un tel processus de « réparation », aucun représentant des espèces possédant un système circulatoire n’aurait pu survivre car, dès la première blessure, il se serait vidé de son sang.
Cela dit, pénétrons par la physiologie2 à l’intérieur de l’organisme pour découvrir quel processus cicatriciel est mis en œuvre afin d’éviter que l’organisme soit mis en péril. Après avoir examiné ce processus si banal, si ordinaire, le lecteur pourra se demander quel hasard aurait pu en être à l’origine.
L’hémostase
Le premier phénomène que l’on constate, lorsqu’il y a effraction ou lésion du derme, est un saignement. Celui-ci s’arrête spontanément. C’est le stade de l’hémostase. Quels sont les phénomènes qui le régissent ? La blessure provoque immédiatement un spasme vasculaire, phénomène réflexe placé sous la dépendance du système nerveux autonome : le diamètre des vaisseaux lésés va se réduire (vasoconstriction), perdant jusqu’à 40%. Ce premier phénomène dure de 15 à 60 secondes chez un homme normal. Son but est de réduire l’écoulement. Dans le cas d‘une blessure par coupure, les lèvres de la plaie se referment, favorisant et améliorant ainsi l’efficacité du processus hémostatique. Ces réactions ont pour but de favoriser l’accolement des lèvres de la blessure et de leurs surfaces endothéliales3 pour la poursuite du processus cicatriciel.
Le clou plaquettaire
C’est la phase qui se met en place dès l’arrêt du saignement.
Tout le monde a entendu parler des plaquettes contenues dans le sang et de leur nombre indispensable, souvent contrôlé par les analyses. Que sont-elles et à quoi servent-elles ?
Elles se nomment aussi « thrombocytes ». Ce sont des sortes de petites cellules circulant dans le plasma sanguin. Leur fonction est de permettre la coagulation du sang et aussi d’éviter tout saignement à l’intérieur du corps.
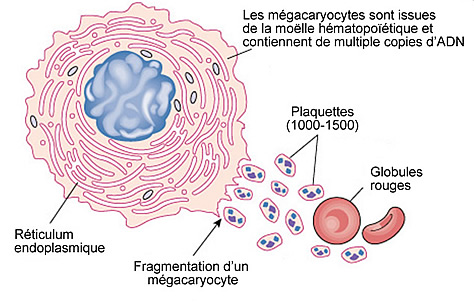
Fig. 2 : Plaquettes
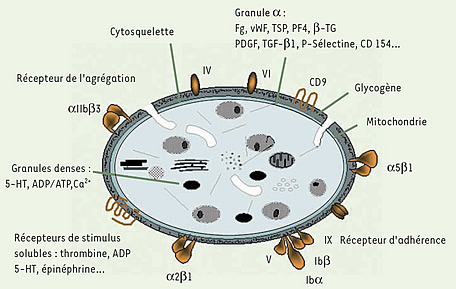
Fig. 3 : Mégacaryocyte. Les plaquettes ne sont pas des cellules à proprement parler, puisque dépourvues de noyau, mais des fragments de cellules provenant de bourgeonnements cellulaires des mégacaryocytes, sortes de grosses cellules issues de la moelle osseuse, de la même lignée que les globules rouges et les leucocytes (globules blancs). Un seul mégacaryocyte peut produire 1 000 à 8 000 plaquettes, qui font partie des éléments figurés4 du sang et ont une durée de vie très courte – de 8 à 10 jours –, avant d’être dégradées dans la rate. On estime que 200 milliards de plaquettes sont produites chaque jour, soit une présence normale de 150 000 à 400 000 plaquettes par µl (microlitre) de sang. Les plaquettes sont donc un élément indispensable à l’hémostase primaire.
Dans une situation normale, les plaquettes n’adhèrent pas à la paroi interne des vaisseaux sanguins (ce qui aurait pour effet de les obstruer), parce que les cellules du revêtement interne des vaisseaux (cellules endothéliales, de forme plate) émettent une prostacycline qui inhibe l’agrégation plaquettaire. Cette prostacycline est sécrétée grâce à l’enzyme5 prostacyclesynthéotase qui agit sur la prostaglandine H26 (ou PGH2), en fait un précurseur de prostaglandine dont le rôle est d’augmenter l’inflammation. Mais, lors d’une lésion vasculaire, les plaquettes vont entrer en contact avec le collagène des parois de vaisseaux qui sont mises à nu. Elles vont changer de forme pour libérer des substances agrégantes (ATP, désérotonine, adrénaline, noradrénaline et thromboxane A2 ou TXA2), qui viennent renforcer et prolonger la vasoconstriction des vaisseaux lésés. Tout ceci va activer l’agrégation des plaquettes grâce à la présence de molécules de fibrinogène7 et de calcium, qui se fixent sur des récepteurs situés sur la membrane plaquettaire. Grâce à ces récepteurs membranaires, les plaquettes vont adhérer au sous-endothélium et aux parois des vaisseaux. Ce phénomène est très rapide.
Des molécules d’adhésion (adhésives) vont se créer à la surface des plaquettes circulant dans le sang. Elles vont se coller aux plaquettes qui ont commencé à s’agréger. Les plaquettes se lient au collagène des parois du tissu lésé pour former un amas : le clou plaquettaire, et leur agrégation stimule l’adhésion des plaquettes entre elles. L’agrégation des plaquettes s’effectue par l’intermédiaire du fibrinogène qui va établir des ponts entre les plaquettes8.
Ce clou plaquettaire crée une barrière provisoire qui obture les vaisseaux lésés : le saignement s’arrête.
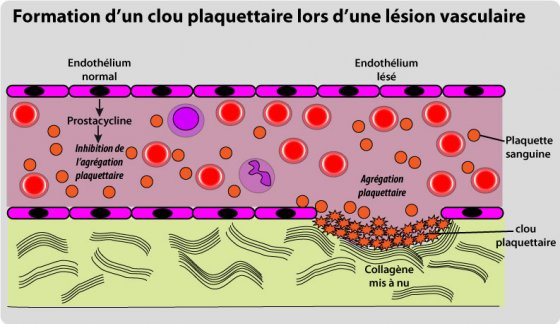
Fig. 4 : Formation du clou plaquettaire.
La coagulation
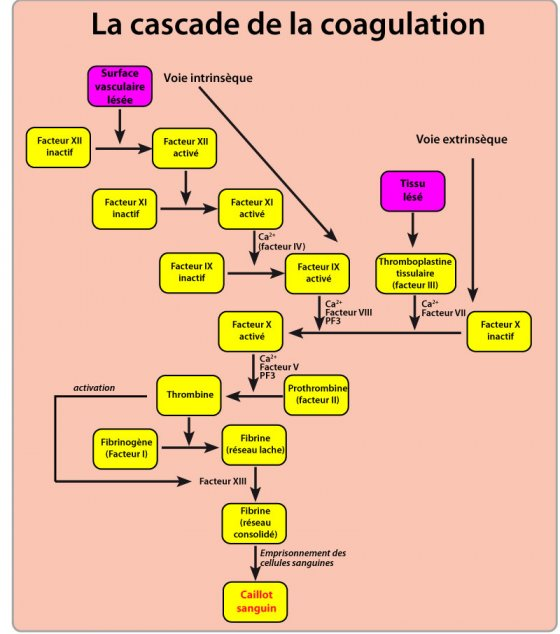
L’hémostase ainsi réalisée avec la fin du saignement, la phase de coagulation du sang va pouvoir intervenir. Une phase préparatoire s’effectue par le contact d’une protéine plasmatique (le facteur VI de la coagulation) avec les tissus lésés. La coagulation va exiger une cascade complexe de facteurs de coagulation qui transformera, une fois arrivée à son terme, le fibrinogène (ou facteur 1 de la coagulation) en fibrine polymérisée qui devient le caillot. Ce processus dure de 3 à 6 minutes après la rupture de vaisseaux.
Le caillot
Arrivé à ce stade, s’enclenche le processus de formation du caillot. Il va englober le clou plaquettaire, le renforcer et colmater les brèches vasculaires.
Il se compose de globules rouges et d’autres cellules sanguines dans un réseau fortement imprégné de fibrine et de fibronectine plasmatique9, de throbospondine10 et de vitronectine11. Le caillot attire et stimule la croissance des cellules du tissu de soutien de la peau (fibroblastes) et des cellules du muscle lisse des parois vasculaires. Ainsi le processus de réparation est en place et la phase de cicatrisation peut commencer. À terme, il en résultera la dissolution du caillot (fibrinolyse).
Pour le détail, afin de mieux montrer la complexité croissante des phénomènes intervenant à ce stade par rapport aux phases précédentes, voici d’autres précisions qui vont permettre de comprendre combien ce microcosme sanguin est régi par des lois extrêmement précises, dont tout dérèglement enraye aussitôt le processus cicatriciel.
Nous avons vu que la coagulation nécessite la présence d’un certain nombre d’éléments, dont les cellules endothéliales12, des monocytes et des fibroblastes13, qui sont capables d’exprimer le facteur tissulaire (en abrégé : FT)14. Sous l’action de diverses cytokines15, plaquettes et fibroblastes vont sécréter des FT qui vont amplifier la coagulation.
Ainsi, la production du caillot de fibrine se trouve être le résultat d’une cascade de réactions, laquelle implique des facteurs de coagulation du plasma, pour aboutir à la conversion du fibrinogène soluble en fibrine, une molécule filamenteuse insoluble. Cette conversion nécessite l’action d’un catalyseur, la thrombine, enzyme qui est activée sur le site de la blessure. Cette thrombine est habituellement présente sous une forme inactive : la prothrombine. L’activation en thrombine s’effectue sous l’action d’un facteur de coagulation, le facteur X (ou F 10). Ce facteur X est présent dans le plasma sous une forme inactive, devant donc elle aussi être activée, etc. Nous sommes en présence d’une cascade de coagulation, qui exige la présence de 12 facteurs plasmatiques (précurseurs) pour aboutir à la conversion du fibrinogène en fibrine grâce à l’action de la thrombine. Les précurseurs, une fois convertis en forme active, sont tous transformés en enzymes protéolytiques. La cascade de coagulation utilise deux voies : la voie intrinsèque (elle dépend du FT et requiert les facteurs de coagulation dissous dans le sang) qui déclenche la coagulation dans un vaisseau lésé (elle comporte sept étapes), et la voie extrinsèque (voie tissulaire) qui aboutit à la coagulation du sang déversé dans les tissus par la lésion vasculaire et comportant quatre étapes. Ces deux voies se déroulent simultanément lors d’une lésion cutanée.
L’élément déclencheur de la coagulation se trouve être précisément le FT, récepteur membranaire du facteur VII. Lorsqu’un vaisseau est coupé, le FT, qui s’exprime alors à la surface des cellules de la paroi lésée et des fibroblastes, entre en contact avec le sang et active le facteur VII grâce à son récepteur.
Mais il arrive que la quantité de FT exprimée soit variable (en excès ou en défaut), ce qui pourrait avoir de graves conséquences si un système de régulation, surveillant le bon déroulement de cette cascade de réactions, n’intervenait pas pour tout corriger. Si le FT se trouve présent en excès, le facteur VII activera directement, c’est-à-dire mollement, le facteur X, mais si le FT est insuffisant, alors le complexe FT/Facteur VII activera le facteur IX, et ce dernier, en présence de son cofacteur spécifique, activera d’une manière plus active le facteur X ; aussitôt la prothrombine se transformera en thrombine quelle que soit la quantité initiale de FT.
Une fois le caillot formé, les plaquettes agglomérées, qui y sont emprisonnées, vont induire un phénomène de rétraction du réseau de fibrine qui le compose, permettant ainsi de rapprocher les bords de la plaie. Au cours de ce phénomène de rétraction, du sérum présent en son sein est expulsé ; c’est du plasma, mais sans ses précurseurs en facteurs de coagulation et sans le fibrinogène converti pendant la coagulation, sinon le phénomène de cicatrisation s’arrêterait.
L’inflammation
Dès la blessure, parallèlement aux phénomènes accompagnant le saignement que nous venons de décrire, va se créer localement un état inflammatoire. En notes 7 et 8, nous avons souligné les actions de la prostaglandine H2 et du fibrinogène dans l’augmentation du processus inflammatoire lors de la formation du clou plaquettaire. Cette inflammation a pour but de lutter contre les agressions extérieures, comme les bactéries et les virus. C’est un processus bénéfique normal et nécessaire, face à toute atteinte d’un tissu. Il se compose de 3 événements importants :
- un apport de sang supplémentaire dans la zone affectée ;
- une perméabilité capillaire nettement augmentée ;
- une migration de leucocytes vers la zone enflammée, à partir des capillaires dilatés, ce qui va contrer les germes amenés par la blessure.
La situation de stress psychologique
Autrefois, l’on disait que, pour bien guérir, il fallait avoir envie de guérir, qu’un bon moral facilitait la guérison. Cela était basé sur l’observation, mais des esprits chagrins, parfois même des médecins, reléguaient ces observations dans le placard aux dictons de « bonnes femmes ». « Aujourd’hui il est connu que le cerveau, les systèmes immunitaire et neuroendocrinien forment un complexe réseau d’intercommunication, utilisant un langage commun par le biais de neurotransmetteurs, de cytokines et d’hormones. On comprend que le cerveau régule, dans une certaine mesure, le système immunitaire et les autres systèmes. Les facteurs psychologiques peuvent aussi affecter ces systèmes à travers le cerveau, et ceux-ci, à leur tour, peuvent influencer notre comportement… Il n’est plus question d’une division réelle entre l’esprit et le corps, en raison des interconnexions scientifiquement établies entre les différents systèmes de notre corps16 ».
Les recherches et les expérimentations ont établi qu’il existe des relations bidirectionnelles entre le comportement, le cerveau, le système immunitaire et le système endocrinien.
Les hormones et les neurotransmetteurs, qui sont libérés au cours des situations stressantes, ainsi que la plupart des médiateurs, ont des récepteurs dans les cellules immunitaires et peuvent ainsi influencer défavorablement la réponse immunitaire en causant des altérations dans les systèmes neuroendocrinien et immunitaire.
La cicatrisation superficielle
La cicatrisation est la phase de régénération qui répare les tissus lésés en réunissant et en consolidant les tissus séparés par la lésion.
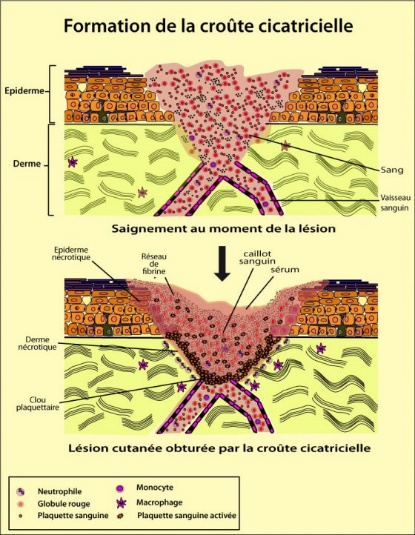
Fig. 5 : Cicatrisation de la peau.
Cicatrisation de la peau : elle concerne la partie superficielle de la lésion. Comme elle présente une destruction cellulaire cutanée, les cellules nécrosées vont libérer un facteur de croissance épidermique (hormone protéique).
Sous son influence, les cellules saines de la couche basale épidermique vont se multiplier et migrer vers la lésion. Ce mouvement s’arrêtera lorsque la zone lésée sera comblée par de nouvelles cellules qui, à leur tour, vont se multiplier pour reconstituer les différentes couches de la peau lésée. Ce phénomène dure de 24 à 48 heures pour les cas légers.
La cicatrisation en profondeur
Si la blessure a touché une zone profonde, la cicatrisation va s’effectuer en quatre phases :
- Phase inflammatoire : elle consiste à éliminer en quelques jours les corps étrangers, qui y auront été introduits, ainsi que les tissus nécrosés. La réaction inflammatoire nécessaire va augmenter la perméabilité des vaisseaux et stimuler aussi le système immunitaire par l’augmentation de l’expression d’un récepteur spécifique, l’EGF. De nouveaux vaisseaux sanguins commencent à se former par bourgeonnement sur les vaisseaux sectionnés, afin de pouvoir apporter les nutriments et l’oxygène indispensables pour nourrir les nouvelles cellules.
- Phase de migration : le caillot, par prolifération des filaments de fibrine, va devenir une croûte. C’est un tissu de renouvellement qui entame le processus d’élaboration de la cicatrice. Sous la croûte, toutes les nouvelles cellules du tissu conjonctif migrent vers le centre de la lésion, tandis que les vaisseaux se réparent.
- Phase de prolifération : on assiste alors à une prolifération massive des cellules conjonctives, des vaisseaux et des fibres. Les fibroblastes17 du tissu conjonctif vont alors migrer en suivant le réseau de fibrine. Au niveau des berges de la plaie, se produit une ré-épithélialisation de la peau.
- Phase de maturation : c‘est la plus longue (elle peut s’étendre sur une année, selon la profondeur et la gravité de la plaie). L’inflammation régresse pour disparaître. La croûte tombe tout d’abord car la peau retrouve toutes ses différentes couches cellulaires, le nombre de fibroblastes diminue ainsi que la quantité de vaisseaux qui va redevenir normale. La peau reste de couleur blanchâtre car le taux de mélanocytes (cellule contenant de la mélanine qui donne la couleur à la peau) ne s’est pas encore suffisamment reconstitué.
Au bout d’environ 6 mois, en cas de cicatrice profonde, la peau devra être redevenue souple et indolore.
II. L’évolution exclue par les phénomènes inflammatoires
[L’article reçu comportait ici une seconde partie consacrée à la réaction immunitaire et aux phénomènes inflammatoires, partie très technique et comportant des schémas complexes impossibles à reproduire dans le format de la revue. Les lecteurs intéressés pourront demander à recevoir cette seconde partie.]
III. Conclusion.
Pour une simple égratignure provoquant un petit saignement, c’est donc tout un monde en vigilance qui se met en ordre de bataille pour la préservation de l’organisme. Ce monde miniature est un microcosme autonome (indépendant de notre volonté), merveilleusement bien organisé et ordonné en vue d’une finalité programmée à l’avance : la réparation de la blessure. Le colmatage de l’écoulement sanguin, la réparation (cicatrisation) de la zone lésée avec ses caractéristiques tissulaires propres, la lutte à mort contre les bactéries étrangères introduites, avec l’élimination des « déchets » par des cellules « poubelles », montrent la présence d’une « société » cellulaire éminemment fonctionnelle et efficace.
Chaque cellule y possède un rôle bien précis. L‘information circule de cellule en cellule avec des ordres finement détaillés. Nous n’apercevons ici aucune place pour de l’improvisation.
Tout y est réglé avec une très grande précision selon des réactions biochimiques en cascades complexes, comme nous avons pu le voir. Or cet article ne donne qu’un faible aperçu de l’organisation de nos défenses, d’autant plus que nos connaissances dans ce domaine voient survenir des développements fréquents. Ajoutons à cela les fonctions endocriniennes, métaboliques, hormonales, etc., dont la complexité est aussi manifeste. La recherche médicale nous fait apercevoir le déroulement de l’action cellulaire dans cette organisation, mais elle est incapable de nous dire comment cela a pu s’organiser et s’ordonner d’emblée selon un plan directeur permettant une telle efficacité, et, ce, dès le départ, car l’erreur ou le tâtonnement n’était pas permis, la survie de l’espèce étant en jeu. Des tâtonnements par ébauches intermédiaires et perfectionnements progressifs sont ici exclus : tout y fonctionne à l’encontre du hasard. Tout était en place avec le système sanguin complet dès le début, organisé pour une finalité bien précise ; il ne pouvait pas en être autrement.
Redisons-le : la réponse de l’organisme à une agression se montre d’une telle complexité que la notion même de hasard n’y trouve aucune place. La théorie de l’évolution, quelle qu’en soit la variante, n’y trouve pas sa place non plus et s’invalide d’elle-même de par son concept. Les partisans de l’évolution se gardent bien d’évoquer en détail ce qui se passe à l’intérieur du corps pour justifier leur théorie. Certains de leurs écrits font appel à l’argument « génétique » en général, sans approfondissement, pour faire apparaître leur thèse comme résultant des avancées de la science, mais ils sont incapables de montrer comment cela serait possible, ou alors manifestent une profonde méconnaissance du sujet.
Comment des phénomènes aussi complexes ont-ils pu se mettre en place sans tâtonnements et être opérationnels immédiatement pour la survie de l’espèce ? La main du Créateur se montre ici avec évidence pour qui veut bien s’interroger.
La théorie de l’évolution est en dehors de la science, car aucun fait scientifique irréfutable n’a jamais pu démontrer sa validité, et bien des réalités la contredisent.
Croire en l’évolution devient une gageure, un dogme, une religion que l’on cherche à imposer sous mode d’arguments autoritaires, sans débat contradictoire ni démonstrations. André Frossard l’avait très bien compris en écrivant avec humour : « Toute religion a ses mystères et l’évolutionnisme se distingue des autres en ceci qu’il nous propose encore plus de miracles. »
Bibliographie :
- HAJISHENGALLIS G., “Periodontitis : from microbial immune subversion to systemic inflammation”, Nat Rev Immunol, janv. 2015, 15(1) : 30-44.
- TEZAL M. et al., “Chronic periodontitis and the incidence of head and neck squamous cell carcinoma”, Cancer Epidemiol Biomarkers Prev., sept. 2009, 18(9) : 2 406-12.
- LEISHMAN S. J., DO H. L. & FORD P. J., “Cardiovascular disease and the role of oral bacteria”, J. Oral Microbiol., déc. 2010, 21; 2.
- KOZIEL J., MYDEL P. & POTEMPA J., “The link between periodontal disease and rheumatoid arthritis : an updated review”, Curr Rheumatol Rep. mars 2014, 16(3) : 408.
- LUNDBERG K. et al., “Antibodies to citrullinated alpha-enolase peptide 1 are specific for rheumatoid arthritis and cross-react with bacterial enolase”, Arthritis Rheum., oct. 2008, 58(10) : 3009-19.
- Université de Pennsylvanie, Philadelphie, É-U., Nature Reviews immunology, vol. 15, janv. 2015, p. 30-45. nature.com/ reviews/immunol
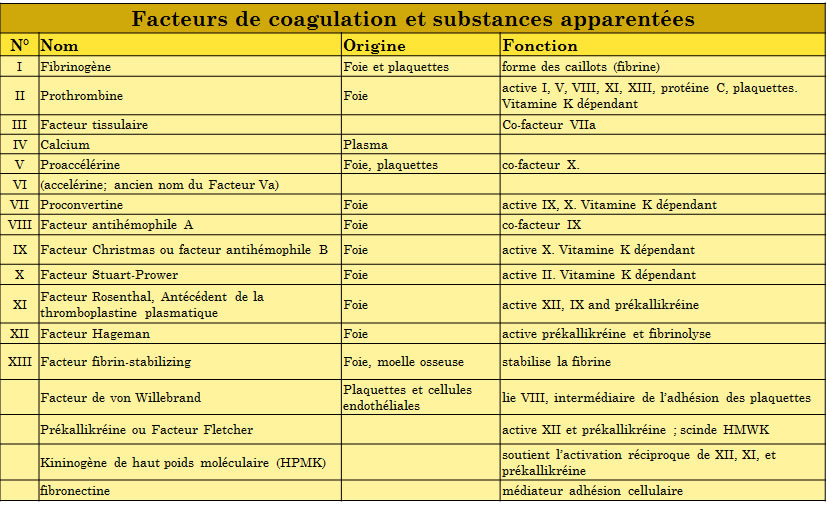
1 Ainsi, par exemple, beaucoup savent que l’aspirine possède des effets anticoagulants par sa propriété anti-agrégats plaquettaires et qu’utilisée à petites doses journalières répétées (environ 10 fois moindres que la normale), elle devient un médicament anticoagulant dans le domaine de la cardiologie. Il a été noté le cas d’une personne atteinte de spondylarthrite ankylosante qui se soulageait avec des prises assez régulières d’aspirine. Un choc sur la racine du nez avait provoqué une petite coupure d’un centimètre qu’elle avait essayé d’arrêter en l’épongeant avec quantité de serviettes éponges pour finalement décéder totalement exsangue ; cf. Michel SAPANET, Les Nouvelles Chroniques d’un médecin légiste, Paris, Pocket, 2015, p. 75-77. Je me souviens d’un jeune patient qui avait un déficit du facteur VII (la proconvertine, voir tableau ci-après). La chute d’une dent de lait, événement plus que banal chez l’enfant, était devenue pour lui catastrophique puisque, la coagulation ne se faisant pas, s’il y avait saignement, cela se continuait par une petite hémorragie interminable avec passage à l’hôpital pour une transfusion sanguine.
2 Physiologie : discipline de la biologie dont le rôle est d’étudier le fonctionnement et les propriétés d’un organe ou d’un tissu chez un être vivant. Elle sert de fondement à la pratique médicale.
3 Les parois internes des vaisseaux sanguins.
4 Ndlr. On nomme « éléments figurés » du sang les cellules présentes dans le plasma, principalement les globules rouges et blancs et les plaquettes.
5 Enzyme : protéine qui permet l’activation ou l’accélération d’une réaction chimique dans l’organisme. Il en existerait environ 15 000 chez l’homme.
6 Prostaglandine H2 : acide gras insaturé présent dans de nombreux organes. Malgré son nom similaire, elle est un précurseur de la prostaglandine. Il en existe une vingtaine classée en 9 catégories selon leur structure chimique.
7 Fibrinogène : protéine soluble du plasma sanguin, synthétisée par le foie, qui participe à la formation du caillot sanguin et module aussi l’activité des plaquettes. Le taux de fibrinogènes augmente l’état inflammatoire. Sous l’action d’une autre protéine : la thrombine, le fibrinogène se transforme en fibrine.
8 L’agrégation des plaquettes qui en résulte est normalement réversible, ce qui serait un facteur défavorable à la poursuite du processus de coagulation vers la formation du caillot. Heureusement, ce processus va se stabiliser, puis prendre une forme irréversible sous l’action d’enzymes et du contenu granulaire libéré par les plaquettes.
9 Fibronectine plasmatique : glycoprotéine présente dans la matrice extracellulaire (circulation sanguine). Elle joue un rôle essentiel dans l’adhésion des plaquettes à la matrice extracellulaire. Le gène qui l’exprime (FN1) se situe sur le chromosome n°2.
10 Throbospondine : sous l’effet de la thrombine, les plaquettes sécrètent une protéine volumineuse de poids moléculaire élevé, la throbospondine, qui va jouer un rôle important dans leur agrégation.
11 Vitronectine : possède les mêmes propriétés que la fibronectine, provient du plasma sanguin débarrassé de ses éléments figurés (cf. note 4). C’est aussi une glycoprotéine, association d’un sucre avec une protéine.
12 Cellules endothéliales : cellules qui tapissent la paroi interne des vaisseaux en contact avec le sang circulant. Elles assurent l’intégrité des vaisseaux sanguins et laissent passer les petites molécules, l’eau pour nourrir les cellules ainsi que les globules blancs, qui pénètrent entre les cellules endothéliales en s’étirant.
13 Fibroblastes : gros globules blancs ayant pour rôle de détruire certains types de bactéries et de virus. Ils sont de la famille des granulocytes qui évoluent massivement en macrophages, à la demande de l’organisme, en vue de migrer vers le site de la blessure. Les macrophages sont chargés d’éliminer les déchets (comme les débris cellulaires) et de détruire les agents pathogènes ; ils font aussi partie du système immunitaire.
14 Le facteur tissulaire, ou facteur III, est un récepteur transmembranaire qui se lie au facteur VII pour activer le facteur IX de la coagulation.
15 Cytokines : médiateurs chimiques du système immunitaire. Innombrables substances de « signalisation » opérant une sorte de langage/dialogue entre les différentes cellules de l’organisme. Elles sont aussi essentielles que les hormones et les neuromédiateurs.
16 Helen FLIX, « Psychoneuroimmunologie et Micro-Immunothérapie : des effets synergiques », Focus n° 6, p. 3, déc. 2014.
17 Fibroblastes : cellules de soutien, responsables de la formation des fibres collagènes, très présentes dans le tissu conjonctif (tissu de soutien et de remplissage de l’organisme). Elles ont pour caractéristiques de posséder une forme en « fusée » et de se multiplier très facilement et rapidement de manière à assurer leur prolifération nécessaire à la cicatrisation.
