Partager la publication "Le Pic : un percusionniste surdoué"
Par Primavère, Bruno
Résumé : Le Pic, fait bien connu, aime à creuser le bois en frappant avec son bec pointu. Mais les prouesses dont il est capable supposent tout un ensemble d’organes vraiment spéciaux. Le bec supérieur, légèrement plus long et relié au crâne par un os spongieux, amortit le choc grâce à sa corne qui se déforme et ne transmet ainsi qu’une fraction d’un choc énorme : le bec frappe le bois à la vitesse d’un cycliste (20 km/h), et cela 20 fois par seconde et 12 000 fois par jour ! Un os particulier, l’os hyoïde, reprend l’effort près de la narine gauche, puis contourne le crâne et revient vers le bec comme support de la langue. Le cerveau est ainsi protégé de 99,7 % de l’impact. Pour pouvoir frapper tout en se tenant à la verticale, le Pic dispose de griffes adaptées, et les plumes rectrices de sa queue lui permettent de prendre appui sur le tronc. Il est clair qu’aucun « hasard organisateur » n’est capable de créer une telle merveille !
Des amis du bois
Les Pics font partie de l’Ordre des Piciformes, ordre composé de 9 familles. Parmi elles, les Picidés, famille d’oiseaux dont la plupart ont des caractéristiques communes leur permettant de s’adapter à une vie arboricole. Elle est constituée de 30 genres et de 234 espèces. La taille des espèces de la famille des Picidés est très variable : elle va de 7,5 cm à 60 cm !
Les Pics ne volent que sur des trajets très brefs, inspectant systématiquement les arbres un à un. En vol, les Pics décrivent d’élégantes trajectoires ondulées. Ils s’élèvent graduellement en battant rapidement des ailes, puis, brusquement, collent leurs ailes contre leurs corps et se laissent tomber en suivant une courbe un peu plus prononcée que la courbe ascendante. Après quoi, ils recommencent à monter. Lorsqu’ils arrivent à proximité d’un arbre, ils descendent jusqu’à quelques mètres du sol et s’accrochent au tronc ; ensuite, ils grimpent avec une grande rapidité jusqu’à la cime de l’arbre, par une série de petits sauts, souvent en décrivant une large spirale.
Ils ne descendent jamais la tête la première et vont peu sur les branches horizontales ; quand ils le font, ils se tiennent souvent sous la branche et la parcourent à toute vitesse.

Le nid est toujours creusé dans le bois d’un arbre. Le « berceau » est formé de quelques copeaux recouvrant le fond du trou. Il recevra 3 à 8 œufs, très blancs et brillants, couvés à tour de rôle par les parents. À l’éclosion, les petits, nus, ont déjà une callosité très développée à l’articulation du tarse et du tibia ; cette excroissance protégera la patte en contact avec le bois. Merci au Créateur pour cette délicatesse dans la conception de cet oiseau très utile à l’Homme puisqu’il « nettoie » les arbres parasités !
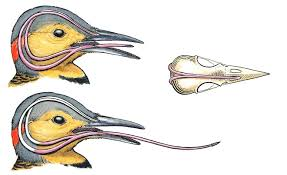
Bien que possédant tous le même outillage, les habitudes alimentaires des pics varient selon les espèces. S’il est arboricole, le Pic vert préfère chercher sa nourriture au sol. Son régime alimentaire peut être constitué à 99 % de fourmis, qu’il atteint dans leurs galeries grâce à sa longue langue collante : on dit qu’il est « myrmécophage ». La langue peut jaillir hors du bec d’une dizaine de centimètres alors que l’oiseau en mesure trente !
Certaines espèces, comme le Pic épeiche, mangent aussi des baies et des graines (par exemple de cônes de pin) qu’elles conservent dans des cachettes. Le besoin en larves d’insectes ne concerne que les oisillons au nid. De nombreux oiseaux passent au régime insectivore lors du nourrissage des petits (Sitelle, Bruant, etc.). Le monde vivant présente de façon analogue d’autres exemples de différences alimentaires entre petits et adultes : le frelon, par exemple, attrape des diptères pour faire une bouillie de leur thorax, riche en protéines, et en nourrir ses larves. Il se nourrit, lui, de liquides sucrés trouvés dans la sève, le nectar des fleurs, les fruits mûrs,… ou fournis par ses larves.

Étant donné ce qui vient d’être dit, il est difficile d’affirmer que c’est la lutte pour l’existence qui a contraint les pics adultes à évoluer et à commencer à taper le bois après une mutation heureuse. Ils pouvaient, eux, se nourrir autrement.
Le Pic vert reste malhabile au sol mais sa spécialité diététique lui fait oublier cet inconvénient. Dès l’apparition du premier pic, l’individu devait pouvoir creuser le bois pour nourrir suffisamment ses petits et aussi pour avoir un abri et une cachette les mettant à l’abri des prédateurs. Les pics sont cavernicoles et sans leur trou, situé dans une position ad hoc dans les arbres1, ils seraient très vulnérables.
Comment opère notre marteau piqueur
Description des différentes « pièces »

Les courtes pattes robustes des Pics présentent quatre longs doigts, deux tournés vers l’avant et deux vers l’arrière : on dit qu’ils sont zygodactyles. Tous les doigts sont armés de griffes très solides, pointues et arquées, leur permettant de s’accrocher aisément aux troncs en s’y agrippant aux moindres aspérités. Rester ainsi à la verticale2, appuyé sur sa queue, ne lui coûte aucun effort. C’est même sa position de repos3.
Les ailes sont d’une longueur moyenne et, en général, légèrement arrondies. Caractéristique étonnante : les rectrices (plumes de la queue) médianes sont plus longues et plus résistantes que les autres. Elles confèrent ainsi une remarquable aptitude à grimper à la verticale, et surtout à demeurer dans cette position, en utilisant presque toujours la queue comme appui. Quand les Pics s’appuient sur leur queue, les pointes des rectrices exercent une certaine pression contre la surface de l’écorce et s’arc-boutent solidement sur ses irrégularités, empêchant ainsi l’oiseau de glisser en arrière. Le tuyau central des plumes, rigide et renforcé, porte des barbes raides4, bien adaptées à l’usure causée par le frottement contre le bois. Le plumage est presque complètement dépourvu de duvet.

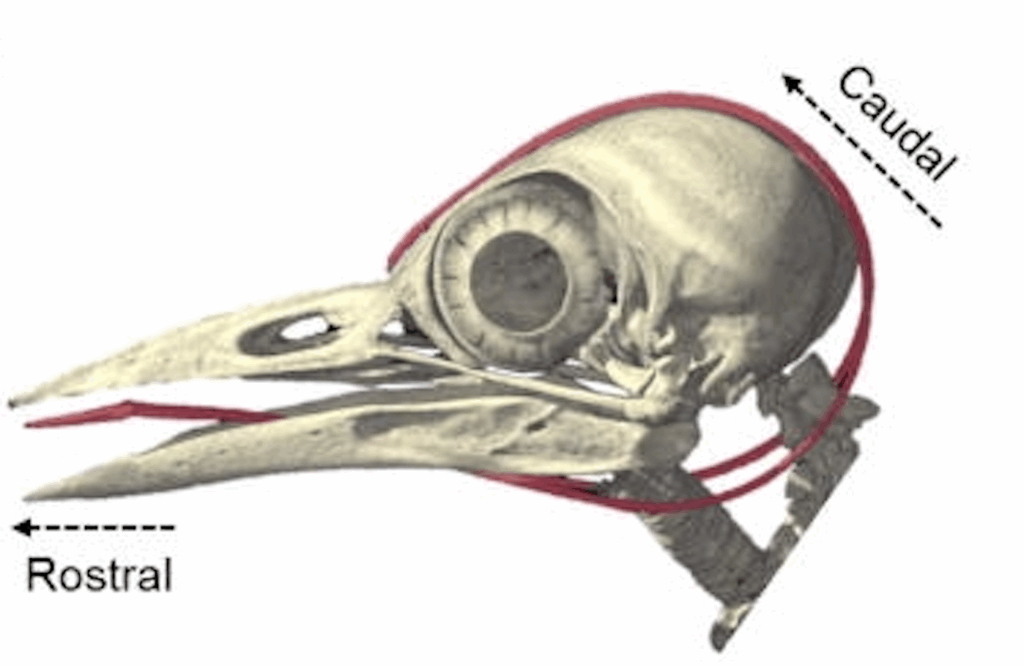
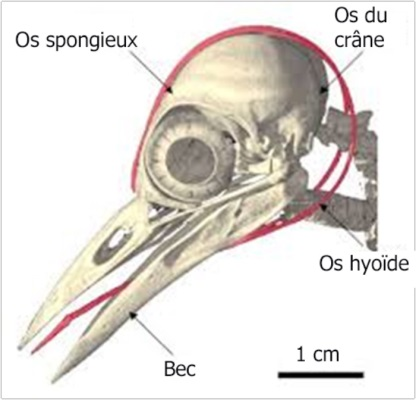
Le crâne des Picidés est doté de deux crêtes latérales qui s’étendent vers la partie postérieure de la tête. Sur l’extérieur de ces crêtes se trouvent des sillons dans lesquels viennent s’insérer les cornes de l’os hyoïde. Sur cet os (en rouge ci-dessous) est implantée la langue : mince, cornée et munie à son extrémité de pointes crochues. La partie cornée de l‘os, orientés vers l’arrière, représente à peu près deux fois les deux tiers de la longueur totale. Grâce à cette structure particulière, la langue peut être projetée vers l’avant et sortir du bec de dix centimètres.

Os hyoïde de Huppe (c)
Os hyoïde de Pic (b)
Les langues des oiseaux sont différentes de notre langue purement musculaire.

Sur toute la longueur de la langue du pic se trouve l’« appareil hyoïde », un tissu musculo-tendineux comportant une série linéaire de minuscules os gainés de muscles et de tissus mous, qui sert de site de fixation pour les muscles autour de la gorge et de la langue.
L’os hyoïde lui-même commence à l’extrémité de la langue, passe à travers la mandibule, où il se divise en deux parties, puis encercle le crâne. Il s’ancre finalement au niveau de la narine droite (chez les autres oiseaux l’os hyoïde se termine à la mandibule) où sa gaine fusionne avec la membrane nasale.

La partie cornée divisée en deux branches représente environ 1/3 de la longueur totale de l’os hyoïde chez les poulets, mais environ 2/3 de la longueur totale chez les pics.
La langue, mince et protractile, longue et gluante, est munie de barbillons pointés vers l’arrière servant à retenir les proies. Elle s’insinue dans les trous les plus exigus pour y cueillir les insectes qui s’y cachent et suit tous les méandres des galeries grâce à sa grande flexibilité. Deux glandes, placées de chaque côté de la mandibule inférieure, sécrètent un mucus visqueux qui couvre la langue et englue les insectes. La langue peut également être utilisée pour roder la sève.
Lorsque le pic veut tirer la langue, il contracte les muscles près de la base de l’appareil hyoïde. Cela force les os hyoïdes vers l’avant dans leur gaine et propulse la langue hors du bec. La relaxation des muscles permet à la langue de se raccourcir et de la ramener à l’intérieur.
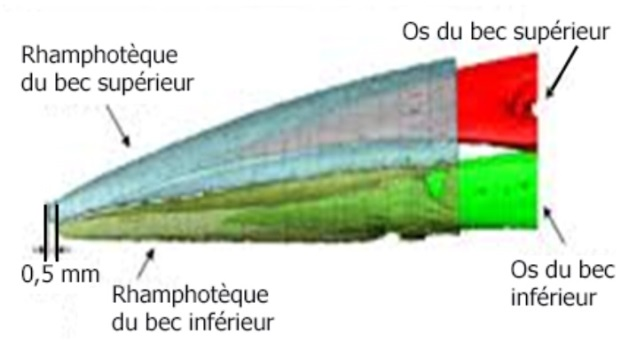
Le bec des pics est droit et tranchant à son extrémité. Sa croissance continue (plus rapide que chez les autres oiseaux : 0,1 à 0,3 mm/j pour le pic épeiche) compense l’usure quotidienne due aux rudes travaux de l’oiseau. À l’échelle macroscopique, le bec comprend trois couches structurelles: une couche externe de rhamphothèque (gaine de kératine), une couche intermédiaire de mousse et une couche osseuse interne. La fraction de surface de chaque couche change tout au long du bec, donnant lieu à un comportement constitutif variable, similaire à celui des matériaux fonctionnellement calibrés. À l’échelle microscopique, la rhamphothèque comprend des écailles de kératine qui sont placées selon un motif avec chevauchement ; la couche de mousse intermédiaire a une structure poreuse, et la couche osseuse a une grande cavité centrale. À l’échelle nanométrique, un espace ondulé entre les échelles de kératine, semblable à une ligne de suture (articulation dentelée de deux os) a été mis en évidence dans la rhamphothèque ; la couche de mousse intermédiaire relie ces deux matériaux différents ; des fibres de collagène minéralisées ont été révélées dans la couche osseuse interne.
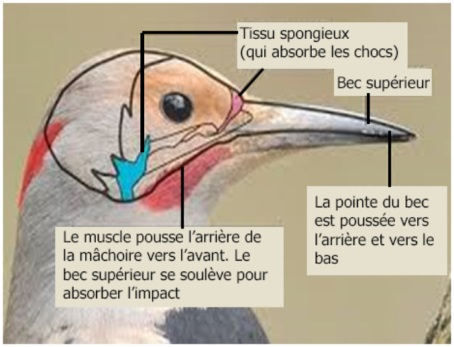
La couche de tissu externe du bec supérieur dépasse de jusqu’à 1,6 mm celle du bec inférieur ; inversement, sa partie osseuse est plus courte d’environ 1,2 mm.
Le bec du pic est capable de soulever des écorces même très dures, de piocher les souches et de creuser des cavités atteignant 25 cm de profondeur. Il s’en sert comme d’un ciseau à bois, soit pour chercher de la nourriture (fourmis, larves d’insectes xylophages,…), soit pour creuser sa loge de nidification. Sans compter le tambourinage à la saison de la reproduction !
Pour réaliser ces trous comme un marteau piqueur, mais en se tenant à la verticale, il faut avoir les griffes des pattes ad hoc, le point d’appui des rectrices, un squelette avec un centre de gravité ne déportant pas trop vers l’arrière. Tout cela rien que pour la stabilité !
Que d’opportunes mutations puissent produire un tel ensemble d’organes spécialement coordonnés, cela est réfuté par sa complexité irréductible, composé qu’il est du bec, du crâne, du squelette, des rectrices des ailes, des muscles avec leurs insertions, de l’appareil hyoïde, des yeux…
Coups de tête à répétition
Les pics tambourinent et forent le tronc des arbres. On peut légitimement se demander comment leur tête peut résister à ces chocs répétés sans cesse ! Que ce soit grâce aux muscles du cou, aux os du crâne, au bec et à la mâchoire, tout est agencé pour mettre le pic à l’abri de vibrations dommageables pour son cerveau.
De nombreux travaux scientifiques ont été menés là-dessus. D’une part, pour apporter des réponses au problème des traumatismes crâniens et des lésions cérébrales consécutives à un choc [prévention des traumatismes et de la pathologie tau (neurodégénérative)] ; d’autre part, pour en trouver des applications dans la conception d’engins spatiaux [ces engins sont confrontés au danger constant de collisions avec des débris et des micrométéorites (cf. Wu et al.)], d’automobiles et d’équipements de protection portables.
Un film tourné à 2 000 vues par seconde montre que le bec d’un pic se précipite sur le tronc à la vitesse d’un cycliste qui fonce sur un mur : 20-25 km/heure. Mais quelques fractions de seconde avant l’impact, le pic freine. Un coup de frein tellement brutal que les yeux devraient logiquement être expulsés des orbites. Or, trois millièmes de seconde avant le choc, les puissantes paupières du pic (dont la membrane nictitante) se ferment.
Un pic peut tambouriner 18 à 22 fois par seconde (parfois jusqu’à 25 hertz) et 12 000 fois par jour. Pendant le processus de tambourinage et de forage, la vitesse maximale de la tête d’un pic est d’environ 6 à 7 m/s (21 à 25 km/h) et la décélération de la tête est supérieure à 1 200 g à l’impact ! Le tambourinage, à la saison des amours, ressemble à une rafale de mitrailleuse comportant 35 à 45 coups de bec pendant 3 secondes contre un bois mort ou creux propre à amplifier le son produit. Le Pic noir, qui peut atteindre 51 cm, a un tambourinage très puissant et sonore, le plus long de tous les pics, à une cadence de 20 coups par seconde. Tous les Picidés ne font pas la même « musique » en frappant une branche sèche.
Cela considéré, l’on n’observe aucun traumatisme crânien chez les pics. En revanche, un humain soumis à une décélération aussi élevée subirait des lésions cérébrales importantes.
La capacité unique du pic à éviter les lésions cérébrales traumatiques a conduit les chercheurs à étudier les mécanismes d’absorption d’énergie dans son crâne. L’ensemble du corps non seulement aide le pic à picorer sur l’arbre, mais stocke aussi le plus gros de l’énergie d’impact sous forme d’énergie de déformation (99,7 %), ce qui réduit considérablement la quantité de l’énergie d’impact qui pénètre jusqu’au cerveau (0,3 %) [ZhaoDan Zhu et al., 2014]. Les pics n’ont donc pas d’effet direct sur leur tête, grâce à leur bec hautement spécialisé, qui dissipe la force avant qu’elle ne soit transmise jusqu’au crâne [Bock WJ, 1999].
Il s’avère, de plus, que les pics possèdent des mécanismes protégeant les yeux des secousses ou des chocs. Leurs yeux diffèrent des nôtres par l’incapacité du globe à se déplacer axialement dans l’orbite, l’impossibilité pour la sclère à se déformer et pour le vitré à cisailler la rétine [Le mouvement de leur globe axial est restreint en raison d’un ajustement serré dans l’orbite et des connexions fasciales entre le bord orbitaire et la sclère. La sclérotique est renforcée par du cartilage et de l’os, le nerf optique manque de redondance et le vitré n’a pas de pièces jointes à la rétine du pôle postérieur (Wygnanski-Jaffe et al., 2007)].
Plusieurs caractéristiques anatomiques sont liées à l’absorption d’énergie. En comparant les crânes chez le pic et chez différents oiseaux (poulet, pigeon, huppe) [Jae-Young Jung et al., 2018 ; Ni Y et al., 2017], il fut découvert que les pics ont des adaptations d’absorption des chocs qui leur sont propres. Cela comprend les os du crâne [Oda et al, 2006], les muscles du cou, le bec et les os spécialisés de la langue.
* La courte durée d’impact du picage (de l’ordre de la milliseconde) [Gibson, 2006] et la trajectoire linéaire du mouvement contribuent à réduire le choc. Wang et al. ont montré, dans une étude comprenant des mesures de la trajectoire de picage et de la force, qu’un bec inférieur plus long réduirait significativement la force de picage.
* Le bec du pic est pointu, droit, de longueur inégale entre bec supérieur et bec inférieur. C’est un outil spécialisé efficace pour découper un arbre. Contrairement aux ciseaux fabriqués par l’homme, le bec est auto-affûtant [Wang et al., 2011]. Possédant une propriété viscoélastique, il est relativement grand par rapport au corps. Cette caractéristique endosquelettique empêche que les excitations mécaniques incidentes [c’est-à-dire l’impact des tambourinages], n’atteignent directement le cerveau. Une première dissipation de l’impact se fait par les écailles de la kératine. Lorsque le bec du pic heurte un objet, la force d’impact élevée à son extrémité est soulagée par l’anatomie du bec (forme, taille, composition) et l’os hyoïde spongieux. En conséquence, la force de contrainte due à l’impact est réduite de deux à huit fois, entre la pointe du bec et le point où le bec rencontre le crâne.
Nayeon Lee et al. ont étudié le bec du pic de manière expérimentale. Les tests de nano et micro-indentation ont révélé que la dureté (associée à la résistance, au module et à la rigidité) de la couche de rhamphothèque était de deux à trois fois inférieure à celle de la couche osseuse. Comparé à d’autres oiseaux (poulet, pinson, toucan), le bec du pic a des écailles de kératine plus allongées qui peuvent glisser les unes sur les autres, admettant ainsi une dissipation par cisaillement ; tandis qu’à l’échelle nanométrique, le bec a une suture ondulée admettant un cisaillement local. Une moindre porosité dans la couche osseuse renforce le bec et focalise l’onde de contrainte.
C’est le bec supérieur qui percute en premier le tronc, lui qui dispose de plus de rhamphothèque à son extrémité. La conception de l’os hyoïde détourne les vibrations (et tout impact violent) du crâne. En raison de sa longueur, le bec supérieur absorbe plus de choc que le bec inférieur lorsqu’il heurte une surface. Les forces parcourent ensuite le bec, puis elles rencontrent l’os hyoïde à la narine avant de toucher l’os spongieux du crâne. Les contraintes voyagent ensuite le long du trajet de l’os hyoïde, plutôt que de continuer vers le crâne, se diffusant dans les muscles recouvrant l’os ou se déplaçant vers la langue. La langue et son os hyoïde spongieux agissent donc comme un ressort, amortissant la force physique et les vibrations associées.
Une autre caractéristique fascinante de l’os hyoïde d’un pic est que sa résistance augmente de la pointe (76 MPa) à la racine
(131 MPa). Son existence réduit le niveau de contrainte de cisaillement maximale dans le tronc cérébral, améliore la rigidité de la tête et supprime l’oscillation de l’endosquelette après l’impact [Yuzhe Liu et al.].
En complément, un os spongieux est spécialement situé à la position contrecoup du bec [May et al., 1976]. On pense que cet os spongieux répartit uniformément les excitations mécaniques incidentes [l’impact du tambourinage] avant qu’elles n’atteignent le cerveau [Oda et al., 2006].
L’os du bec inférieur étant plus long, c’est lui qui devra absorber la majorité de la pression et déclenchera, sans doute, le relâchement des muscles et le recul de l’oiseau.
Lorsque le pic picore, les muscles entourant l’os hyoïde détendu se contractent, propulsant la langue vers l’avant à l’intérieur du bec, et même plus loin lors de la collecte de nourriture. Cette tension stabilise le crâne et la colonne vertébrale, agissant comme une ceinture de sécurité pour empêcher un mouvement excessif du cerveau. La zone charnière entre la mandibule supérieure et le crâne va, lors d’un choc, subir la tension comme un ressort à lame. Un muscle adapté amortit cette tension.
* Les os du crâne des pics sont plus fins que chez la moyenne des autres oiseaux et le liquide céphalo-rachidien, entre le cerveau et le crâne particulièrement lisse, est moins épais. Le cerveau a donc moins de liberté de mouvements. Pour reprendre une comparaison, le cerveau des autres oiseaux est le jaune d’un œuf cru et le cerveau des pics est le jaune d’un œuf dur. Lorsqu’on les secoue, l’un bouge et l’autre pas !
Malgré les forces qui atteignent le crâne du pic, la structure unique de son os crânien protège son cerveau et sa cavité crânienne. Cet os crânien est un mélange d’os compact dense et serré entourant un os plus profond composé par la superposition en quinconce de plaques qui créent un système dense d’absorption des chocs. Lorsque des efforts se croisent sur cet os plus profond, sa structure poreuse et stratifiée disperse les fréquences dans des directions divergentes à partir du point central de l’impact. Cet os, bien que flexible, serait fragile à lui seul. Mais il est enfermé dans un os compact et le système global maintient la flexibilité à l’intérieur, permettant l’absorption des chocs [Yoon et al ont illustré la capacité d’absorption des chocs de l’os spongieux].
Les os du crâne ont une composition chimique (le rapport Ca/P est plus élevé) et une densité différentes de celles d’autres oiseaux [Jung et al., 2018]. Cette adaptation structurelle est obtenue en augmentant l’accumulation de minéraux dans les os pour les rendre plus rigides et plus solides. L’os du crâne est très mince. Le crâne est adapté pour être à la fois plus dur et plus résistant.

* Lorsque le pic picore, les muscles sont contrôlés avec précision pour accélérer la tête avec une grande efficacité. Au cours du tambourinage le bec reste à la perpendiculaire de l’axe du corps. Lorsque le bec touche le bois, le corps de l’oiseau est parallèle au tronc.
De puissants muscles du cou offrent une protection contre les blessures causées par les forces de rotation. Le muscle principal utilisé pour tambouriner exprime abondamment les deux gènes qui codent pour des protéines soutenant la dynamique de manipulation du calcium myocytique – à savoir la parvalbumine et le réticulum sarcoplasmique Ca2+ ATPase 1 [Schuppe et al., 2018]. Les muscles positionnés le long de la colonne se contractent ou se relaxent en fonction de l’information nerveuse reçue. Comme des vérins, ils ont une taille, une force, des points d’insertion qui sont ajustés. Ils donnent une grande précision au mouvement.
La commande motrice, lors d’un mouvement volontaire, est élaborée au niveau de l’aire corticale motrice. Les muscles impliqués dans un mouvement volontaire se contractent plus ou moins selon le geste que l’on veut effectuer. Soulever une plume ou prendre un enfant dans ses bras ne sollicite pas les muscles de la même façon. Selon le geste à effectuer, certains muscles doivent, eux, se relâcher. Cela exige un traitement nerveux du mouvement, information qui aura pour conséquence de déclencher ou non les modes d’action nécessaires. L’
Des études comparatives entre le Pic épeiche et la Huppe fasciée montrent des différences anatomiques des muscles de la tête et du cou, ainsi que des différences dans la morphologie des vertèbres cervicales [Cui et al., 2018].
Le système musculo tendineux, qui relie les os du squelette et sa commande motrice, a quelque chose de fascinant. Des muscles et des tendons de longueur et de force différentes s‘entrecroisent et se côtoient sans se gêner et en étant parfaitement coordonnée. Et tout cela provient d‘une cellule unique : l‘ovule fécondé !
Quel est le plus admirable des deux : le système de protection antichocs ou le mouvement de tambourinage à la verticale ? À chacun de choisir !
Certains biologistes évolutionnistes, tel Richard Dawkins, jouissent d‘une imagination fertile. Ils peuvent, à partir d‘un point anatomique donné, pourra conter toute une histoire pour arriver à la structure biologique souhaitée. Si ce talent est admirable, il n‘en reste pas moins une arme à double tranchant. Bien que capable de penser à de fictifs chemins d‘évolution que d‘autres ne voient pas, ils ont également tendance à ignorer les nombreux détails et obstacles remettant en question leurs scénarios. Cependant, la science ne peut ignorer les détails et, au niveau moléculaire, tous les « détails » s‘avèrent essentiels. Il suffit qu‘un écrou ou un boulon manque pour que tout un édifice s‘effondre. Les études sur le pic lèvent un coin du voile sur l‘extrême complexité du vivant.
Quand Michael Behe prend la tapette à souris comme exemple de complexité irréductible (enlevez un élément et l‘opération ne peut s‘exécuter), il fait remarquer que la présence des éléments ne suffit pas ; il faut aussi qu‘ils aient la qualité requise (pour la tapette, par exemple, le plateau ne doit pas être en papier). Nous observons la même chose pour le pic et sa capacité de forage. Le tout n‘est pas d‘avoir un bec, des pâtes crochues, des muscles… mais ils doivent être longs ou pointus ou dur et inséré à tel endroit… Il faut que tout ait été pensé avant, de sorte que, lors de l‘embryogenèse, l‘ensemble s‘agence harmonieusement et que la concentration des différentes molécules y soit bien ajustée…
La nature présente une grande diversité d‘êtres vivants ; leur coexistence harmonieuse et leur complémentarité manifestent l‘unicité du Concepteur.
« Que vos œuvres sans grandes, Seigneur, que vos pensées sont profondes ! L’homme stupide n’y connaît rien et l’insensé n’y peut rien comprendre » [Ps 92, 6-7].
Bibliographie
* Les Animaux, n°86 : Les Picidés, Société des périodiques Larousse, 1971.
* www.oiseaux.net
* La Hulotte, n°11-82-83.
* MAY, FUSTER, NEWMAN & HIRSCHMAN, « Woodpeckers and Head Injury », The Lancet, 28 février 1976.
MAY Ph. R. A., FUSTER J. M., HABER J. & HIRSCHMAN A., « Woodpecker Drilling Behavior – an endorsement of the Rotational Theory of Impact Brain Injury », Arch. Neurol., juin 1979.
* BOCK W. J. (1964), « Cinétique du crâne aviaire », Journal of Morphology 114 : 1-41.
* BOCK W. J. (1966) « Une approche de l’analyse fonctionnelle de la forme du bec », The Auk 83 : 10-51.
* BOCK W. J. (1999), « Morphologie fonctionnelle et évolutive des pics », Ostrich 70 : 23-31.
* GIBSON L. J., « Woodpecker picorant : Comment les pics évitent les lésions cérébrales », J. Zool, 2006, 270 : 462-465.
* CUI YaLin, XU Peng, NI YiKun, WANG LiZhen & FAN Y. (2018), Analysis of the anatomical structure of woodpecker head and neck ; https://engine.scichina.com/doi/10.1360/N052017-00293
* JUNG Jae-Young et al., « Analyse structurelle de la langue et de l’appareil hyoïde chez un pic ».
* JUNG Jae-Young et al., « Une analyse comparative du crâne aviaire : pics et poulets », J Mech Behav Biomed Mater, 2018 août ; 84 : 273-280. Doi : 10.1016 / j.jmbbm.2018.05.001.
* NAYEON Lee, HORSTEMEYER M., RHEE H., NABORS B., LIAO J. & WILLIAMS L. N. (2014), « Relations hiérarchiques multi-échelles structures. Propriété du bec du pic à ventre rouge (Melanerpes carolinus) », Journal of The Royal Society, Interface 11, 20140274 10.1098 / rsif.2014.0274.
* Y Ni et al., « Propriétés micro-mécaniques de différents sites sur le crâne du pic », Comput Methods Biomech Biomed Engin, 2017 ; 20 : 1483-1493.
* ODA J., SAKAMOTO J., SAKANO K., « Évaluation mécanique de la structure squelettique et des tissus du pic et de son système amortisseur », JSME Int. J., Ser A, 2006, 49 : 390-396.
* SCHUPPE Eric R., PETERSEN John O. & FUXJAGER Matthew J., « Le comportement des tambours des pics est lié à l’expression élevée de gènes codant pour les protéines de manipulation du calcium dans la musculature du cou », Journal of Experimental Biology, 2018.
* VILLARD P. & CUISIN J., « Comment les pics extraient-ils les larves avec leur langue ? Une étude du Pic de Guadeloupe (Melanerpes herminieri) dans les Antilles françaises », Auk, 2004, 121: 509-514.
* WANG L., CHEUNG J. T., PU F. et coll., « Pourquoi les pics résistent-ils aux traumatismes crâniens : une enquête biomécanique », Plos One, 2011, 6 : e26490.
* WYGNANSKI-JAFFE T., MURPHY C. J., SMITH C et al., « Mécanismes oculaires protecteurs chez les pics », Eye, 2007, 21: 83-89.
* YOON Sh. & PARK S., « Une analyse mécanique du tambourinage des pics et son application aux systèmes d’amortissement des chocs », Bioinspir Biomim, 2011, 6 : 016003.
* LIU Yuzhe, QIU Xinming, ZHANG Xiong & YU T. X., « Réponse de la tête du pic pendant le processus de picage simulée par la méthode du point matériel ».
* ZHU ZhaoDan, ZHANG Wei & WU ChengWei, « Conversion d’énergie chez le pic sur picots successifs et son rôle sur la protection anti-choc du cerveau », Science Chine Sciences technologiques, vol. 57, p. 1 269-1 275 (2014).
* ZHOU P., KONG X. Q., WU C. W. et al., « La nouvelle propriété mécanique de la langue d’un pic », J. Bionic Eng., 2009, 6 : 214-218.
* https://evidenceofdesign.com/about/
* https://theconversation.com/how-do-woodpeckers-avoid-brain-injury-120489
* LI Yang, ZHANG Wei, MENG Qing Ling, JIANG Gang & WU ChengWei, AIP Advances 10, 065001 (2020) ;
https://doi.org/10.1063/5.0004546.
Liste des images présentes dans l’article.
- image1: 7 dessins – 7 photos
1 Cf. La Hulotte n° 82-83.
2 Voir aussi Werner GITT, « Cervelle de moineau », Le Cep n°2, février 1998, § Catapulte et couteau de poche, p. 63.
3 Ndlr. Chez les oiseaux, les points d’attache des tendons des doigts font qu’ils se serrent à mesure que la patte se plie. Ils dorment ainsi en agrippant sans efforts une branche ou un câble.
4 Voir W. E. FILMER, « La plume, merveille de la Création », Le Cep n°21, novembre 2002, p. 84.
